本ページでは、医薬品等電子申請ソフトの様式L15「体外診断用医薬品外国製造業者登録更新申請書」の入力方法についてご紹介します。
医薬品等電子申請ソフトは、執筆時に最新のものを使用しています。
ご使用環境やバージョンによっては、表示や入力方法が異なる可能性がありますのでご了承ください。
申請書の新規作成
まずは、医薬品等電子申請ソフトで「申請書の新規作成」をします。次の①~③のいずれかの方法で「申請書の新規作成」をすることが出来ますので、好きな方法でやってみてください。方法①がワンクリックで簡単です。
「基本操作系ツールバー」の「新規作成」をクリックします。
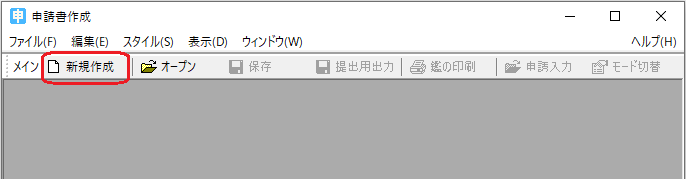
ツールバーの「ファイル(F)」から、「申請書の新規作成(N)」を選択します。
キーボードの「Alt」→「F」→「N」の3つのキーを順番に押していくことで、②と同じ操作をすることが出来ます。外出先などで、マウスがないときにオススメの方法です。(同時押しではなく、順番に押す)

上の①~③のいずれかの手順を踏むと、「新たに作成する申請様式の選択」ウィンドウが立ち上がってきます。ウィンドウが立ち上がってすぐの画面では全ての種類の様式が表示されていますが、下図赤枠のように「申請様式一覧の絞込み設定」をすることで、L14とL15の様式に絞り込まれます。
「様式区分(1)」は「[機体]外国製造業者登録関係」を選択します。
「様式区分(2)」は「外国製造業者登録更新申請書」を選択します。
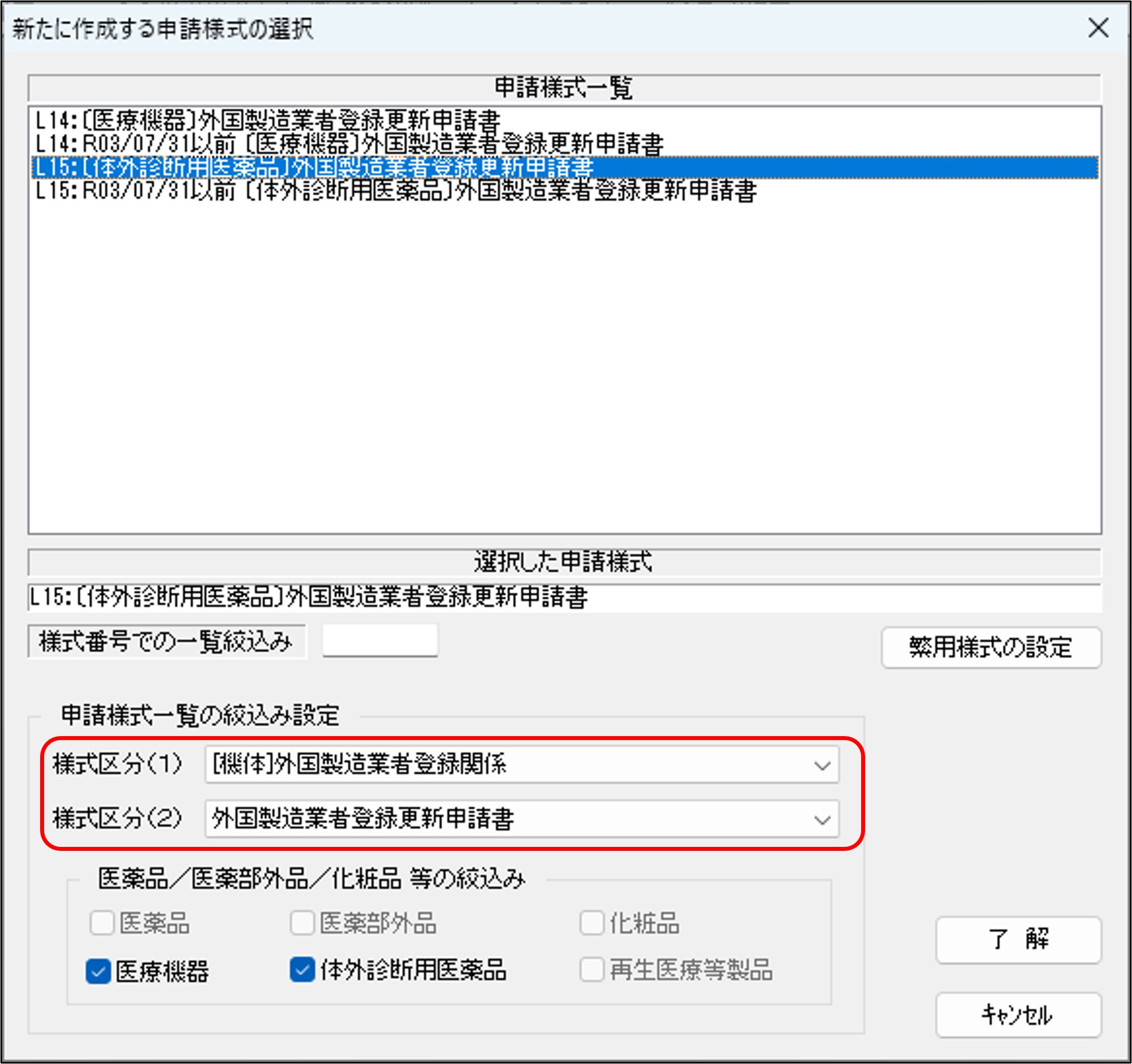
なお、「様式番号での一覧絞込み」で「L15」と入力することでも、更新申請書を絞込むことが出来ます。
※L14は、医療機器外国製造業者の様式になります。本ページでは体外診断用医薬品についてご紹介しているため、L15の様式を選択しますが、医療機器外国製造業者の更新申請書を作成する場合はL14を選択してください。
L15には、2種類の様式があります。「R03/07/31以前」の方の様式は、2021年7月31日以前に作成した更新申請書の内容を確認するために用意されている様式ですので、これから新たに更新申請書を作成する方は「R03/07/31以前」と書かれていない方の様式L15を選択しましょう。古い方の様式で作成してしまうと、PMDAに提出したときに「新しい様式で作成ください」と、言われてしまいますので気を付けましょう。
「申請様式一覧」リストで様式をワンクリックで選択すると選択した様式の行が青色に変わりますので、右下の「了解」をクリックするか、または、「申請様式一覧」リストで様式をダブルクリックすることで様式を開くことが出来ます。
申請情報の入力
申請書の画面になったら、申請情報を入力していきます。次の①~③のいずれかの方法で「申請データ作成」ウィンドウを立ち上げ、入力していきます。方法①がワンクリックで簡単です。
「基本操作系ツールバー」の「申請入力」をクリックします。
ツールバーの「編集(E)」から、「申請書の新規作成(N)」を選択します。
キーボードの「Alt」→「E」→「I」の3つのキーを順番に押していくことで、②と同じ操作をすることが出来ます。外出先などで、マウスがないときにオススメの方法です。(同時押しではなく、順番に押す)

上の①~③のいずれかの手順を踏むと、「申請データ作成」ウィンドウが立ち上がります。ようやく申請情報を入力していくことになります。
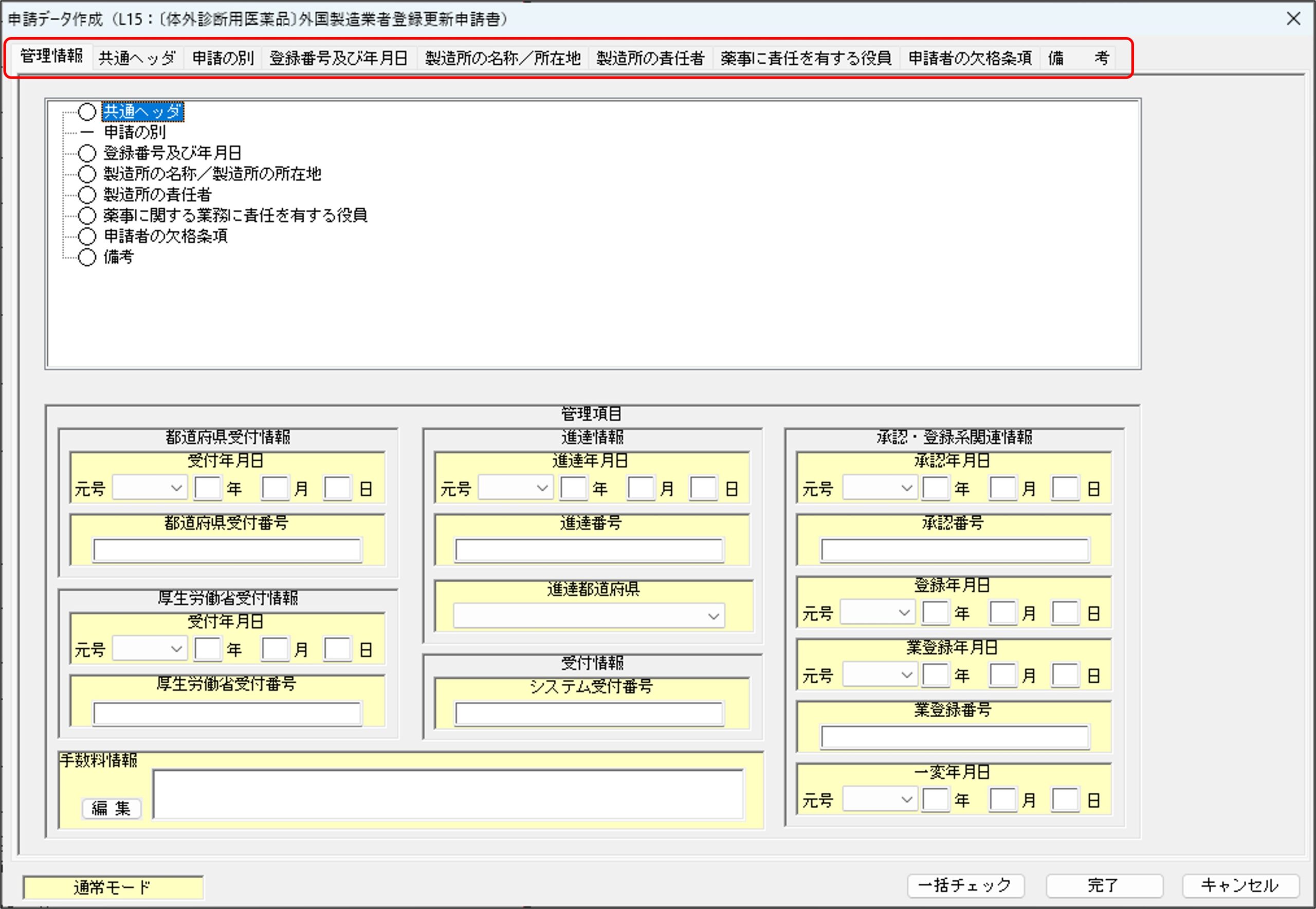
「管理情報」タブ
「申請データ作成」ウィンドウが立ち上がった直後の初期画面では、上図赤枠のうち「管理情報」タブが選択されています。「管理情報」タブについては、申請者側で入力が必要な個所はありませんので、それ以外のタブを順番に選択し、変更届出情報を入力していくことになります。
「共通ヘッダ」タブ
「共通ヘッダ」タブでは、提出者や担当者、手数料など、基本的な情報について入力します。
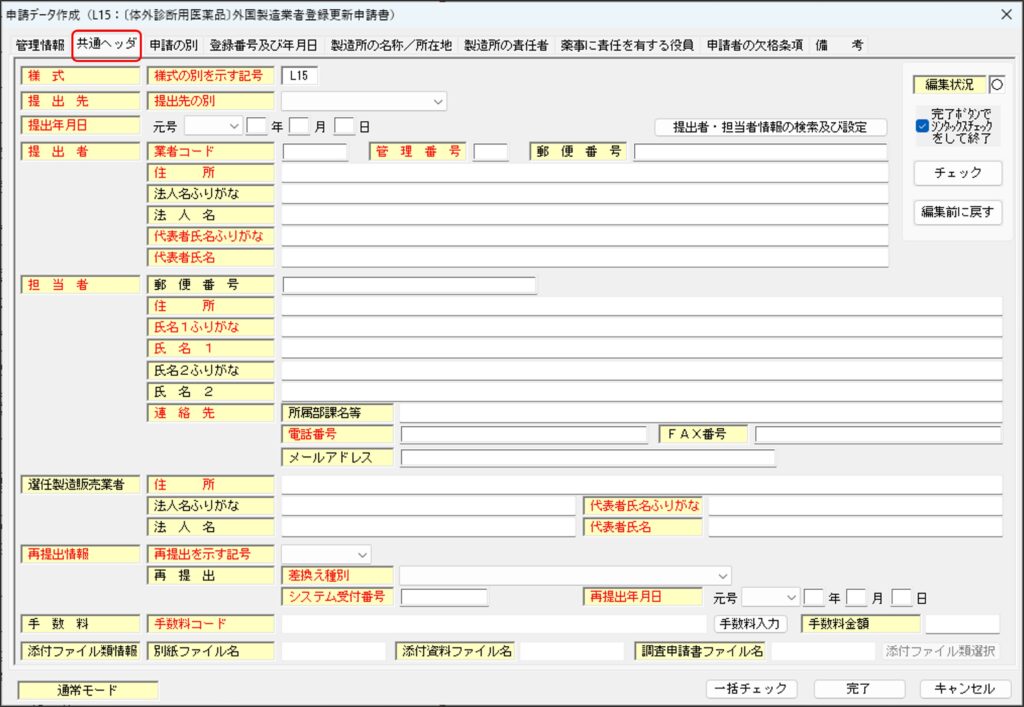
各項目の詳細については、次の通りです。
様式の別を示す記号
提出する様式に対応する様式の別を示す記号「L45」が自動的に表示されています(値の変更不可)。「L45」以外の記号が表示されている場合は申請書の様式の選択が間違っていますので、右下の「キャンセル」ボタンをクリックして「申請データ作成」ウィンドウを閉じ、再度「申請書の新規作成」からやり直してください。
提出先の別
タブ形式になっているので「厚生労働省」を選択します。体外診断用医薬品外国製造業登録の登録権者は厚生労働大臣であるため、提出先は「厚生労働省」とします。
提出年月日
電磁的記録媒体申請(旧FD申請)では「申請書を発送する日」を入力します。オンライン申請では「申請データを送信する日」を入力します。
差換え指示を受けて「再提出」する場合には、初回申請時の提出年月日を入力します。
提出者
提出者の欄には、外国製造業者の情報を入力します。
業者コードは、外国製造業者の業者コード(9 桁)を入力します。下3桁が「000」のコードです。なお、申請代行者の交代時に十分な引継ぎがおこなわれなかった等の理由でコードがどうしても不明な場合は、PMDAホームページの「認定・登録外国製造業者リスト」で確認することが出来ます。リストでは、上6桁(法人部分)と下3桁(事業所部分)の合わせて9桁が掲載されていますが、入力するときには下3桁(事業所部分)を「000」として入力します。
管理番号は、適宜設定した任意の 3 桁の管理番号を入力します。同日中に複数の申請(届出)をする場合には重複しない番号を付番します。例えば、同日中にL45とL15を提出する場合、管理番号はL45で001、L15で002、のように重複しないように付番します。申請日(届出日)が異なる場合には、10/1のL45届出では001、10/15のL15申請でも001、という風に番号が重複してもOKです。
その他の項目(住所、法人名ふりがな、法人名、代表者氏名ふりがな、代表者氏名)は、外国製造業者の現在の登録情報を入力します。外国製造業者の登録情報に変更がある場合には、変更後の最新の登録情報を入力します。
担当者
担当者の欄には、申請を代行する日本企業の情報を入力します。
郵便番号は、ハイフン有り無しどちらでもよいですが、「〒(郵便マーク)」は不要です。
住所は、都道府県名から番地まで入力します。担当者の自宅住所を記載する必要はありません。所属する会社の住所でOKです。
氏名1ふりがな、氏名1は、担当者の氏名を入力します。姓と名の間はスペースがあってもなくてもOKです。ひらがな、カタカナを含む氏名であっても、ふりがなをひらがなで入力します。
例)氏名「田中みつ子」 → ふりがな「たなかみつこ」
氏名2ふりがな、氏名2は、担当者が複数いる場合に入力します。3人目以降は入力できません。
連絡先は、担当者の連絡先を入力します。所属部課名は、申請を代行する日本企業の名称と担当者の所属を入力します。
例)所属部課名「〇〇製薬株式会社 薬事部」
連絡先のメールアドレスは、グループメールアドレスを入力してもOKです。
選任製造販売業者
選任製造販売業者の欄は、製造販売承認申請時に使用しますので外国製造業者登録の更新申請では何も入力しません。
再提出情報
再提出情報の欄は、初めての申請であるか、再提出の申請であるかを入力します。
再提出を示す記号は、初めての申請の場合は「新規申請」を選択します。一度申請が受理され、受付番号が発行された後に差換えの指示を受けた場合は「再提出」を選択します。再提出の場合であっても、例えば「様式が違うので受理できません。正しい様式で再提出してください。」というように受理される前に再提出する場合には「新規申請」を選択します。どちらを選択すればよいか判断できない場合には、PMDAの担当者から再提出の連絡があった際に聞いておくと間違いがないでしょう。
「新規申請」を選択した場合は、再提出情報の入力はこれで終わりです。「再提出」を選択した場合は、続けて差換え種別やシステム受付番号、再提出年月日を入力します。
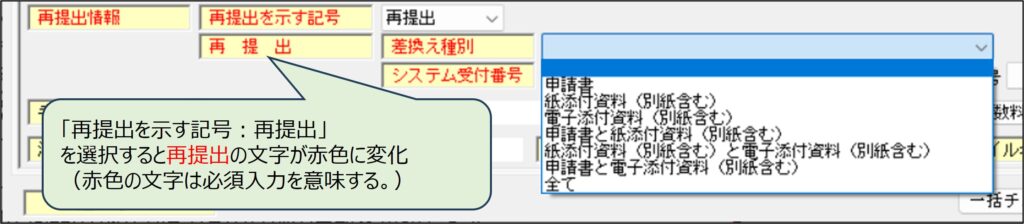
差換え種別は、差換える書類に応じて選択します。「申請書」、「紙添付資料(別紙含む)」、「電子添付資料(別紙含む)」とは、次のものをいいます。
| 申請書 | ・申請書鑑 ・「提出用申請データ形式一覧表示」を出力したもの |
| 紙添付資料(別紙含む) | ・登録証の原本 ・製造所の場所を明らかにした図面(印刷して添付した場合) |
| 電子添付資料(別紙含む) | ・製造所の場所を明らかにした図面(電子的に添付した場合) |
システム受付番号は、13桁の番号です。一度申請が受理されたときに発行される「受付票」に記載されていますので、間違えずに入力します。
再提出年月日は、再提出する日付を入力します。電磁的記録媒体申請(旧FD申請)では「申請書を発送する日」を入力します。オンライン申請では「申請データを送信する日」を入力します。
手数料
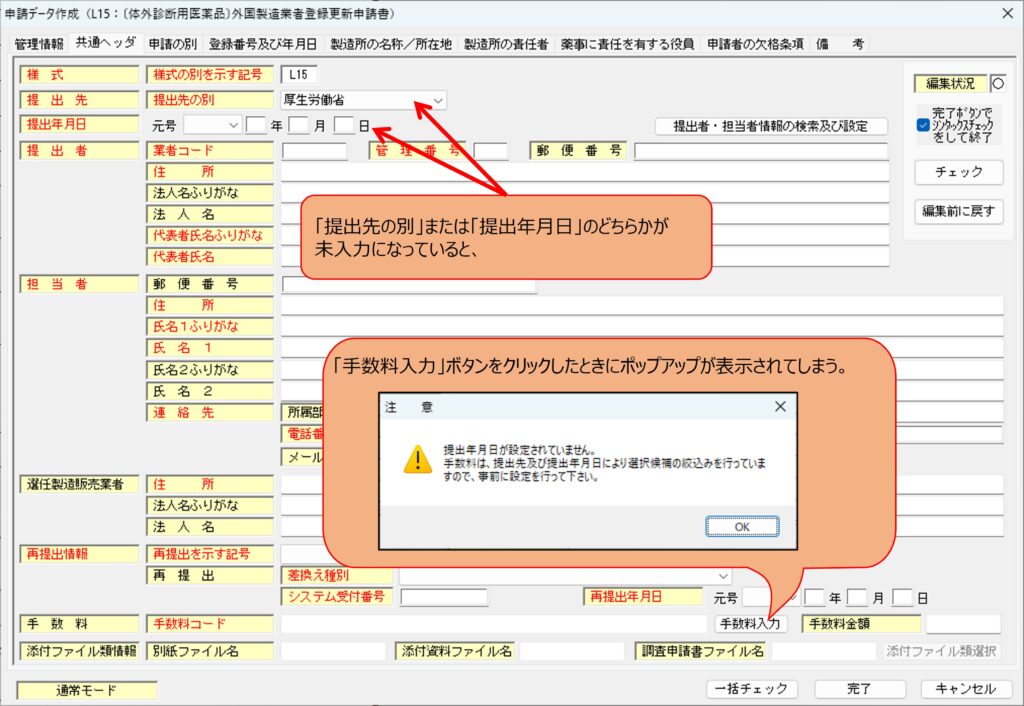
手数料の欄は、更新申請手数料について入力します。「手数料入力」ボタンをクリックして手数料の種類を選び、その後、手数料金額を手入力します。「提出先」または「提出年月日」が入力されていない場合、「手数料入力」ボタンをクリックしたときに、ポップアップが表示されてしまいますのでご注意ください。「提出年月日」がまだ決まっていない場合は、元号だけでも選択しておくことでポップアップが表示されなくなりますのでお試しください。
無事に手数料入力のウィンドウが立ち上がったら、タブで「医療機器等外国製造業者登録更新」を選択します。
手数料金額は、入力できないようになっていますので、空欄でOKです。
添付ファイル類情報
添付ファイル類情報の欄は、入力できないようになっていますので、空欄でOKです。
「申請の別」タブ
「申請の別」のタブでは、申請者側で入力する箇所はありません。「体外診断用医薬品」がデフォルトで入力されています。変更不可です。
「登録番号及び年月日」タブ
「登録番号及び年月日」タブでは、外国製造業者の登録番号と登録年月日について入力します。登録証を確認しながら、間違えないように入力します。
「製造所の名称/所在地」タブ
「登録番号及び年月日」タブでは、外国製造業者の製造所の情報(名称と所在地)を入力します。
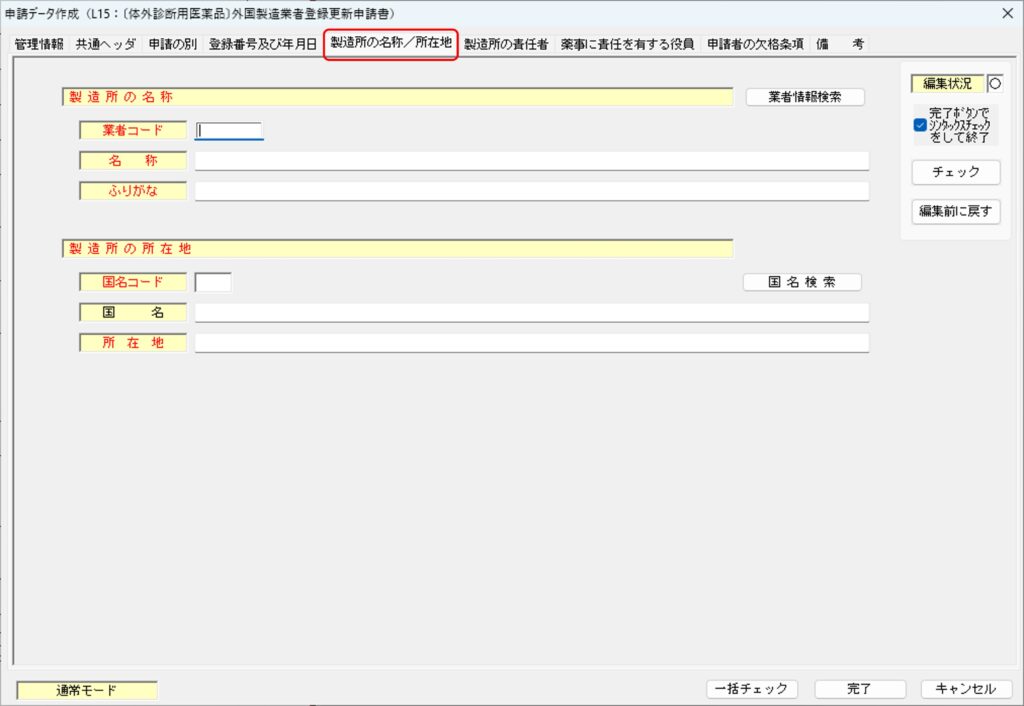
製造所の名称
「製造所の名称」の欄では、業者コードと名称を入力します。
業者コードは、製造所の業者コード(9 桁)を入力します。下3桁が「000」ではないコードです。なお、申請代行者の交代時に十分な引継ぎがおこなわれなかった等の理由でコードがどうしても不明な場合は、PMDAホームページの「認定・登録外国製造業者リスト」で確認することが出来ます。リストでは、上6桁(法人部分)と下3桁(事業所部分)の合わせて9桁が掲載されています。
名称とふりがなは、製造所の現在の登録情報を入力します。製造所の登録情報に変更がある場合には、変更後の最新の登録情報を入力します。
製造所の所在地
「製造所の所在地」の欄では、国コードや国名、所在地を入力します。「国名検索」ボタンをクリックすることで「国名の検索」ウィンドウが立ち上がります。
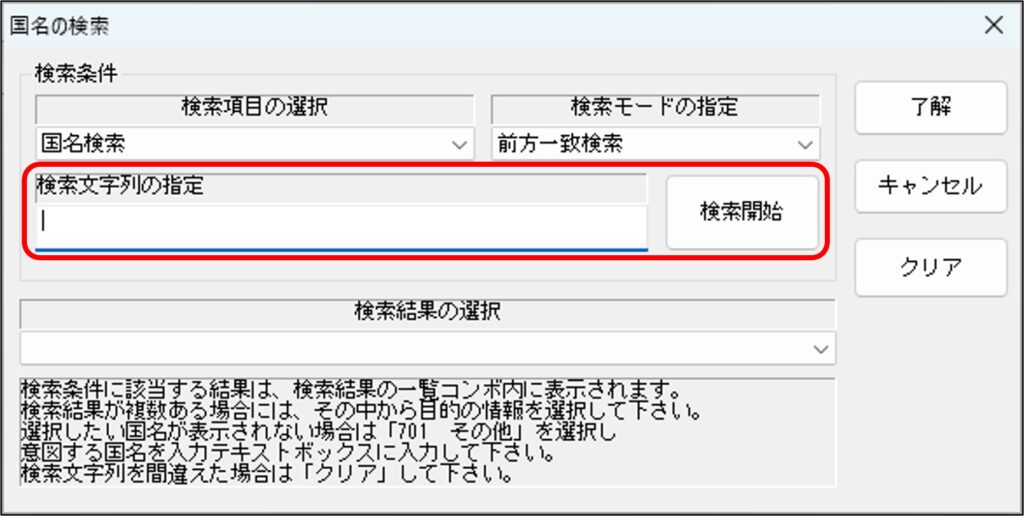
ウィンドウが立ち上がった直後は、「検索項目」が「国名検索」、
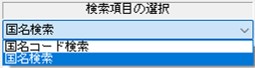
「検索モードの指定」が「前方一致検索」
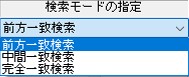
になっていますので、必要に応じて変更します。

「検索モードの指定:中間一致検索」が、
部分一致検索ができますのでオススメです。
「検索モードの指定:前方一致検索」
入力例1:「中」→「中華人民共和国」、「中央アフリカ」がヒット
入力例2:「華」→ヒットなし
入力例3:「韓」→ヒットなし
「検索モードの指定:中間一致検索」 いわゆる「部分一致検索」のこと。
入力例1:「中」→「中華人民共和国」、「中央アフリカ」がヒット
入力例2:「華」→「中華人民共和国」がヒット
入力例3:「韓」→「大韓民国」がヒット
「検索モードの指定:完全一致検索」
入力例1:「中国」→ヒットなし
入力例2:「韓国」→ヒットなし
入力例3:「大韓民国」→「大韓民国」がヒット
「検索文字列の指定」に検索する国名を入力し、「検索開始」ボタンをクリックすると検索結果がヒットします。タブから正しい国名を選択し「了解」ボタンをクリックします。「了解」ボタンをクリックすると、ひとつ前のウィンドウに戻りますので、最後に「所在地」を登録証通りに手入力します。
医薬品等電子申請ソフトの国名検索では、「グルジア」から「ジョージア」の国名変更など、最新の国名が反映されていないものもあり検索しづらい感がありますので、お探しの国名が見つからない時にはコチラのページで検索することもできます。
「製造所の責任者」タブ
「製造所の責任者」タブでは、製造所責任者について入力します。氏名や氏名ふりがな、住所は、製造所責任者の現在の登録情報を入力します。製造所責任者の登録情報に変更がある場合には、変更後の最新の登録情報を入力します。
「薬事に責任を有する役員」タブ
「薬事に責任を有する役員」タブでは、薬事に関する業務に責任を有する役員(以下「責任役員」)の氏名を入力します。基本的には現在の登録情報を入力しますが、登録情報に変更がある場合には変更後の最新の登録情報を入力します。
「申請者の欠格条項」タブ
「申請者の欠格事項」タブでは、申請者の欠格条項について入力します。申請者が法人の場合には、薬事に関する業務に責任を有する役員(以下「責任役員」)が欠格条項に該当しないかどうかについて入力します。
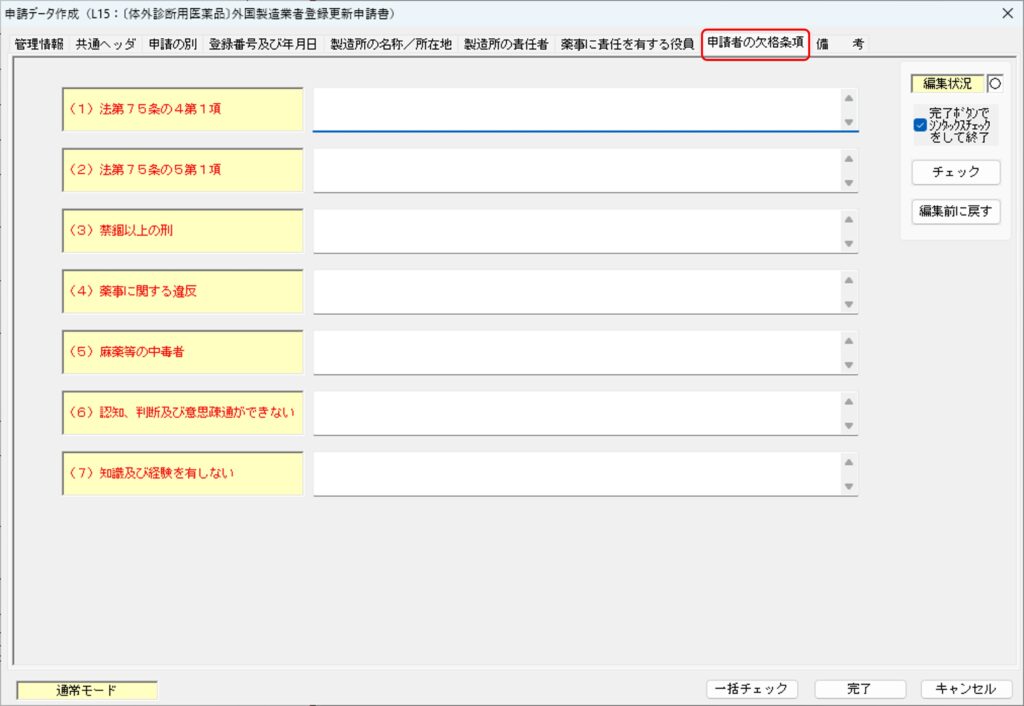
申請者(外国製造業者)が自然人(個人)の場合には、申請者が欠格条項に該当しないかどうか確認し、該当しない場合には「なし」と入力します。
なお、欠格条項に該当する場合には、
- (1)または(2)に該当する場合、その理由と年月日を入力します。
- (3)に該当する場合、その罪、刑、刑の確定年月日、刑の執行が終わった年月日を入力します。
- (4)に該当する場合、その違反の事実、違反した年月日を入力します。
申請者(外国製造業者)が法人(企業)の場合には、責任役員が欠格条項に該当しないかどうか確認し、該当しない場合には「なし」と入力します。責任役員が複数いる場合には、その全員について欠格条項に該当しないかどうかを確認し、該当しない場合には「全員なし」と入力します。
なお、欠格条項に該当する場合には、
- (1)または(2)に該当する場合、該当する者の氏名、理由、年月日を入力します。
- (3)に該当する場合、該当する者の氏名、罪、刑、刑の確定年月日、刑の執行が終わった年月日を入力します。
- (4)に該当する場合、該当する者の氏名、違反の事実、違反した年月日を入力します。
複数の責任役員のうち特定の者のみ欠格条項に該当する場合には「その他の者は欠格条項に該当しない」旨も入力しておきます。
「備考」タブ
「備考」タブでは、その他参考になる情報について入力します。
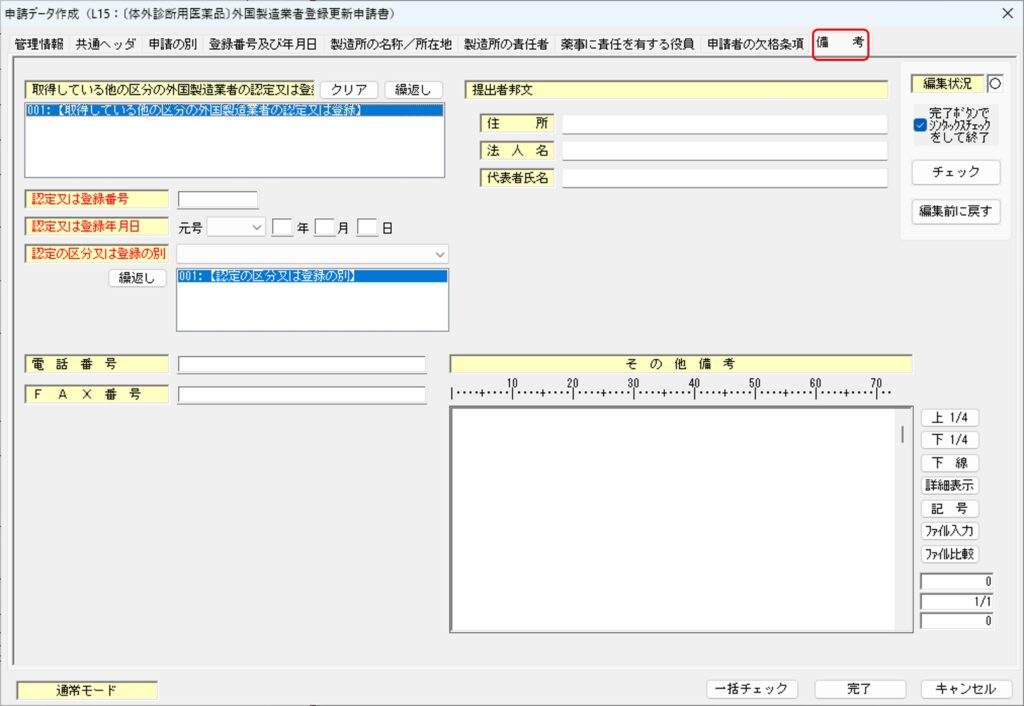
既に取得している他の区分の外国製造業の許可、認定または登録を受けている場合には、「取得している他の区分の外国製造業認定又は登録」 の欄に、次の項目を入力します。複数の許可等を受けている場合には、そのすべてを入力することになります。
- 許可、認定または登録番号
- 許可、認定または登録年月日
- 許可、認定の区分または登録の別(種類)
「備考」タブでは、その他の項目は入力しなくてもOKです。
入力内容のチェック
すべての申請情報の入力が完了したら、右下の「一括チェック」をクリックし、入力誤りや入力漏れがないかどうかチェックします。「データは正しく入力されています。」と表示されれば入力は完了です。
お疲れさまでした。

コメント