こんにちは。ジンです。
皆さんもうご存じかと思いますが、
2022年12月1日から、医薬品等※への特定用符号の表示が法律で義務化されました。
※医薬品、医療機器、再生医療等製品(以下「医薬品等」といいます)で特定用符号の表示が義務化されました。医薬部外品や化粧品は対象外です。
「特定用符号※」とは、医薬品等を特定するための符号で、商品コードや製造番号(ロット番号)、使用期限等の情報を含むバーコードのことをいいます。
特定用符号があるおかげで、医薬品等の平時の流通管理や不具合発生時の回収管理に大きな利点があります。
医薬品等の特定用符号の表示については、これまでは厚生労働省の通知レベルの枠組みの中で運用されてきましたが、2022年12月1日からは法律レベルのルールへと格上げされることになります。
法律レベルに格上げされることで罰則の規定が適用されることになりましたのでご注意ください。
とはいえ、これまで通知で決められていたルールと、新しい法律のルールではあまり大差ありませんので、通知に則ってしっかりと特定用符号の表示をしてきた企業様方にとっては、新たに対応が必要になることはほとんどないと思います。
今回の改正は体外診断用医薬品においても例外ではなく、一般用検査薬以外の全ての体外診断用医薬品については特定用符号の表示が必須となっています。
本ページでは、2022年12月1日に施行された体外診断用医薬品への特定用符号の表示についてご紹介します。
※体外診断用医薬品に特化した内容となっていますので、その他の医療製品では法令の条項や細かいルール等が異なることがあります。体外診断用医薬品以外の医療製品関係者におかれましては大筋の内容を把握する程度にお読みください。
医薬品医療器等法の改正
まずは、根拠となる医薬品医療機器等法の改正から確認していきましょう。

アレルギー反応が出る方はささっと読み飛ばしちゃって下さいね。
2019年に公布された医薬品医療機器等法等を改正する法律(令和元年法律第63号。以下、改正法。)第3条の規定により、医薬品医療機器等法に特定用符号の表示に関する規定が盛り込まれました(2022年12月1日施行)。
改正内容を大まかに把握するために改正箇所を図1にまとめてみました。
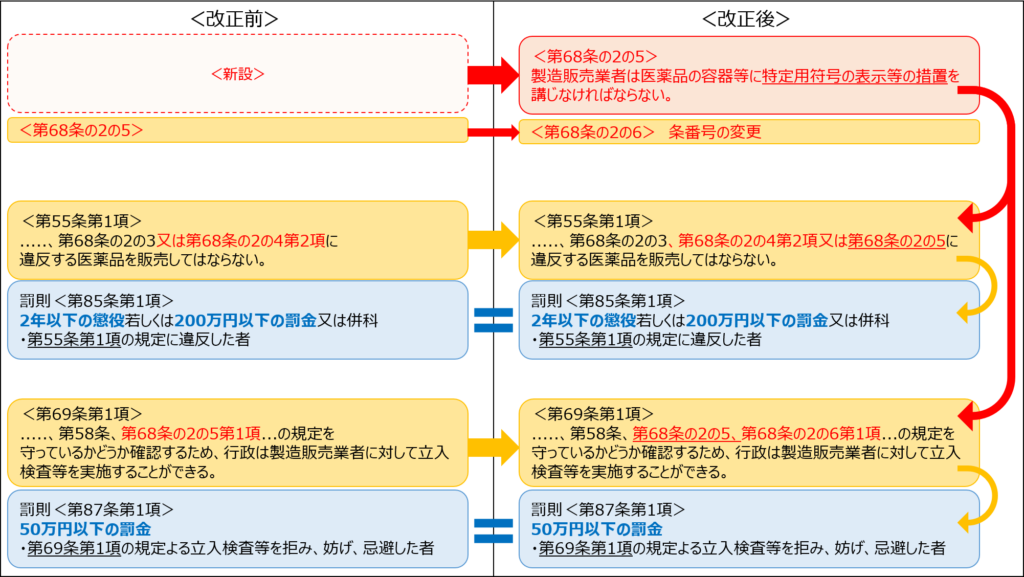
図1中の赤枠(新設)と黄色枠(改正)が今回の改正箇所です。
青枠は改正前後で変わっていません。
特定用符号の表示に関する規定が新設されて(赤枠)、それに関連するルールが改正されることで(黄色枠)、罰則の規定が適用されることとなりました(青枠)。
参考までに、新設された条文を載せておきましょう。
(医薬品、医療機器又は再生医療等製品を特定するための符号の容器への表示等)
医薬品医療機器等法 第68条の2の5 令和元年12月4日法律第63号による改正後(2022年12月1日施行)
医薬品、医療機器又は再生医療等製品の製造販売業者は、厚生労働省令で定める区分に応じ、医薬品、医療機器又は再生医療等製品の特定に資する情報を円滑に提供するため、医薬品、医療機器又は再生医療等製品を特定するための符号のこれらの容器への表示その他の厚生労働省令で定める措置を講じなければならない。
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
必要な対応(誰が?何をすべきか?)
上に新設された条文を載せました。
条文中には色々と書いてありますが不要なところはとりあえず置いておき、大事なところだけ、
誰が?何をすべきか?を抜き出してみましょう。
誰が?
医薬品、医療機器又は再生医療等製品の製造販売業者は、
何をすべきか?
厚生労働省令で定める区分に応じ、厚生労働省令で定める措置を講じなければならない。
非常に簡単になりましたね。
まず「誰が?」ということで、各製造販売業者が実施すべきルールとして規定されています。
具体的に書くと次の製造販売業者が実施します。
- 第一種医薬品製造販売業者
- 第二種医薬品製造販売業者
- 体外診断用医薬品製造販売業者
- 第一種医療機器製造販売業者
- 第二種医療機器製造販売業者
- 第三種医療機器製造販売業者
- 再生医療等製品製造販売業者
医薬品、医療機器または再生医療等製品の製造販売業者が実施すべきルールということですので、体外診断用医薬品も対象となります。
※「体外診断用医薬品を除く」という規定がない限り、「医薬品」という言葉には「体外診断用医薬品」が含まれます。
続いて「何をすべきか?」です。これが1番大事ですね。
「厚生労働省令で定める区分に応じ、厚生労働省令で定める措置を講じなければならない。」とのことですので「厚生労働省令」を見てみましょう。
ここでいう厚生労働省令とは、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則(昭和37年厚生省令第1号、以下「施行規則」)」を指します。
該当する条文を確認してみましょう。
(法第68条の2の5の厚生労働省令で定める措置等)
医薬品医療機器等法施行規則 第228条の10の10第1項 令和4年9月13日厚生労働省令第128号による改正後(2022年12月1日施行)
法第68条の2の5の厚生労働省令で定める措置は、次の各号に掲げる区分に応じ、それぞれ当該各号に定める措置とする。
一 第211条第1項各号に掲げる医薬品、医療機器又は第228条の5第1項各号に掲げる再生医療等製品であつて、その容器又は被包の記載場所の面積が狭いため当該医薬品、医療機器又は当該再生医療等製品を特定するための符号を記載することができないもの(第3号及び第5号に掲げるものを除く。) 当該医薬品、医療機器又は当該再生医療等製品を特定するための符号の当該医薬品、医療機器又は当該再生医療等製品に添付する文書への記載
二 第216条第1項の医薬品(次号に掲げるものを除く。) 当該医薬品の分割販売の相手方たる薬局開設者が当該医薬品の特定に資する情報を適切に把握することができる方法による当該情報の提供
三 前2号のいずれにも該当する医薬品 第1号に定める措置及び前号に定める措置
四 その構造及び性状により容器又は被包に収められない医療機器(次号に掲げるものを除く。) 当該医療機器が使用される間その使用者その他の関係者が当該医療機器の特定に資する情報を適切に把握することができる方法による当該情報の提供
五 電気通信回線を通じて提供される医療機器プログラム 次のイ又はロに掲げる措置
イ 当該医療機器プログラムを提供する前に行う当該医療機器プログラムの販売業者から当該医療機器プログラムを使用する者に対する当該医療機器プログラムの特定に資する情報の提供
ロ 当該医療機器プログラムの製造販売業者から当該医療機器プログラムを使用する者に対する当該医療機器プログラムの提供と併せて行う当該者が容易に閲覧できる方法による当該医療機器プログラムの特定に資する情報を記録した電磁的記録の提供
六 前各号に掲げるもの以外の医薬品、医療機器又は再生医療等製品であつて被包に収められたもの 当該医薬品、医療機器又は再生医療等製品を特定するための符号のこれらの被包への表示
七 前各号に掲げるもの以外の医薬品、医療機器又再生医療等製品 当該医薬品、医療機器又は再生医療等製品を特定するための符号のこれらの容器への表示
原文は 総務省 e-Gov法令検索 にてご確認いただけます。

長いんじゃ―っ!!読めるかっ!

と、いうことで、医薬品に関係する部分だけ表1に簡単に抜き出してみます。
| 号 | 厚生労働省令で定める区分 | 厚生労働省令で定める措置 |
| ① | 表示面積が小さくて記載できない医薬品 ・2mL以下の容器に入った医薬品 ・2~10mLのガラス容器に入った医薬品 | 医薬品に添付する文書に特定用符号を表示する (添付文書(電子添文)でもいいし、ペラ紙に印字してもいい) |
| ② | 調剤専用医薬品 | 分割販売の相手方(薬局開設者)が把握しやすい方法による提供 |
| ③ | 表示面積が小さくて記載できない調剤専用医薬品 (①と②の両方に該当する医薬品) | ①と②の両方の措置 |
| ⑥ | 上記以外の、被包に入った医薬品 | 特定用符号を被包に表示する |
| ⑦ | 上記以外の、容器に入った医薬品 | 特定用符号を容器に表示する |

2mL以下の容器に入った医薬品であっても、容器に直接記載が可能な場合には⑦に該当しますので容器に直接表示することとなります。
体外診断用医薬品については現状「調剤専用医薬品」は存在しませんので、①,⑥,⑦のどれかの区分の措置を実施すればよいということですね。
また、⑥,⑦についてはどちらも”特定用符号を表示せよ”という意味ですので、被包であろうが容器であろうが同じことを言っていますね。
まとめると、次のようになります。
<表示する面積が小さい体外診断用医薬品>①
・添付する文書に「特定用符号」を表示する
<それ以外の体外診断用医薬品>⑥,⑦
・被包または容器に「特定用符号」を表示する
特定用符号とは?
「体外診断用医薬品製造販売業者は、(添付する文書、被包または容器に)特定用符号を表示しなければならない」というところまではわかりました。
では「特定用符号」って何なの?というのが次の問題です。
医薬品医療機器等法では次のように表現されています。
これが、「特定用符号」の正式名称になります。略して「特定用符号」ですね。

ほぇー、で?つまりなんなん?

まぁ、そう焦らずに…。
「特定用符号」が何を指すものであるか具体的に記載されているものはありませんが、厚生労働省の通知が参考になりますので見てみましょう。

「特定用符号」とはワット?セイ、カモン!
(出川イングリッシュ風)
医療機器等の種類に応じ、包装単位ごとに商品コード及び製造識別子を含めて特定用符号を表示する。
●:必須表示(医薬品医療機器等法第68条の2の5に基づく表示義務)
◎:必須表示(通知に基づく表示義務)
○:任意表示(通知に基づく任意表示)バーコード又は二次元コード(以下「コード等」という。)については、GS1-128シンボル又はGS1データマトリックスとする。
「医療機器、体外診断用医薬品等を特定するための符号の容器への表示等について」令和4年9月13日付け医政産情企発0913第2号薬生安発0913第2号
原文は 厚生労働省ホームページ にてご確認いただけます。
色々と用語が出てきていますが、肝心な「特定用符号」とは何か?を直接的に説明するものはありません。なんとなく状況証拠を積み上げると次のような感じでしょうか↓↓
商品コード及び製造識別子を含むバーコード又は二次元コード(GS1-128シンボル又はGS1データマトリックス)
法に定める「特定用符号」と通知中の「バーコード又は二次元コード」の関係性は明確ではありませんが、おそらく同じものでしょう。
通知に従って商品コードや製造識別子を含むバーコードを表示すれば、法令遵守はOKですね。

似たようなものに「注意事項等情報を入手するために必要な符号」というのもありますが、こちらは厚生労働省令で「バーコード又は二次元コードをいう」と明確に記載されています。
電子添文(電子化された添付文書)を見るための符号のことです。
「GS1-128シンボル」と「GS1データマトリックス」のイメージ図を載せておきます。
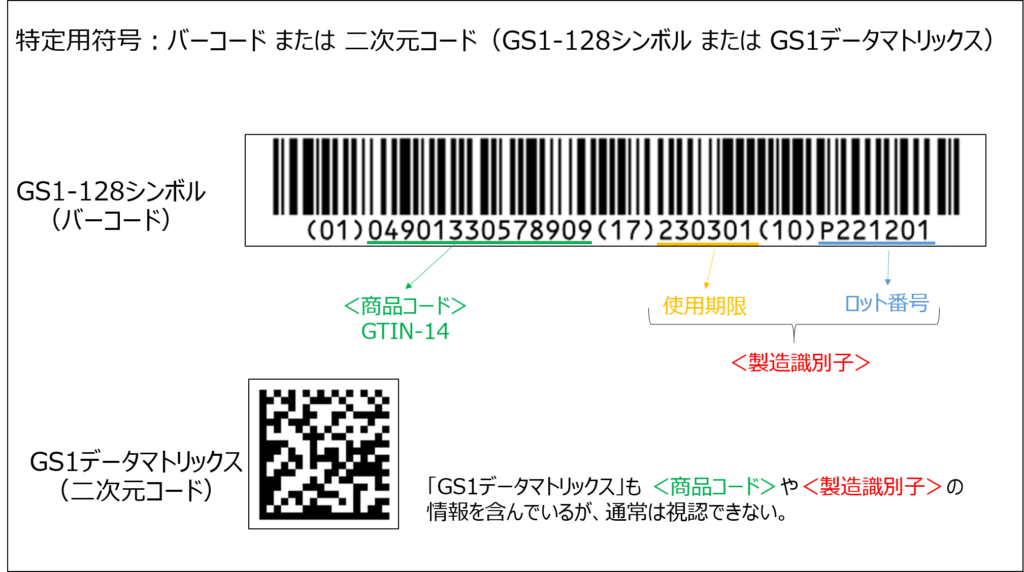
(商品コードは、筆者が大大大好きなじゃがりこのGS1コードを勝手にお借りして作成しました。)
また、2022年9月13日時点でGS1データバー限定型、二層型又はそれらの合成シンボル(CC-A)を使用している製品については、当面の間、それらの継続使用が可能です。

これから特定用符号の表示をする方は「GS1-128シンボル」または「GS1データマトリックス」の2択ですね。
用語
「商品コード」「製造識別子」「包装単位」など、色々な用語が出てきましたのでひとつずつ確認していきましょう。これらの用語は通知中で明確にされています。
商品コード
まずは「商品コード」です。特定用符号に含めなければならない情報のひとつです。
商品コードとは、医療機器等の個々の包装単位及び製品本体を一意に識別する固定的情報である。GS1の識別コードであるGTIN(Global Trade Item Number )(より具体的には、GTIN-13(わが国では、JAN コードと一般的に呼称されているもの)、GTIN-14又はGTIN-12)とする。
「医療機器、体外診断用医薬品等を特定するための符号の容器への表示等について」令和4年9月13日付け医政産情企発0913第2号薬生安発0913第2号
原文は 厚生労働省ホームページ にてご確認いただけます。
「商品コード」は個々の製品に固有のコードであり、通知によると、GTIN-12、GTIN-13(JANコード)、GTIN-14のいずれかを使用することとされています。
GTINについては、GS1 Japan(一般財団法人流通システム開発センター)のホームページがとても分かりやすく解説されていますのでオススメです。
日本に流通させる製品であれば、集合包装を識別する1桁とGTIN-13(JANコード、13桁)を組み合わせたGTIN-14(14桁)を採用しておけばまず間違いないでしょう。
製造識別子
2つ目は「製造識別子」です。「使用期限(有効期限)」と「ロット番号(シリアル番号)」の2つを合わせて「製造識別子」といいます。
製造識別子とは、有効・使用期限及びロット番号又はシリアル番号…等の製造固有の可変情報である。
有効・使用期限には、当該医療機器等の使用に係る最終期限を表示すること(YYMMDD形式-ISO8601形式で記載。年は西暦下2桁、月日は各2桁、日の設定がない場合は、日を00とするか、当該月の末日とする。
「医療機器、体外診断用医薬品等を特定するための符号の容器への表示等について」令和4年9月13日付け医政産情企発0913第2号薬生安発0913第2号
原文は 厚生労働省ホームページ にてご確認いただけます。
使用期限については、数字8つのYYMMDD形式-ISO8601形式で記載することとされています。

ISO8601を読んでみましたが、最新の2019年版にはYYMMDD形式の規定がありませんでした…。2000年版には規定がありましたので、改訂によって削除されたのですかね。
ともあれYYMMDD形式での記載は「GS1-128シンボル」のルールでもありますので、通知に示される通りYYMMDD形式で表示すればOKでしょう。
ロット番号については、製造ロットごとに付番されたロット番号を表示します。
「GS1-128シンボル」の仕様上、ロット番号は半角英数記号(ASCII)20文字までしか入力できませんので、20字を超える長すぎるロット番号や半角英数記号以外の文字を使ったロット番号は付けないようにしましょう。
<使用期限>
OK:2023年3月1日→230301
NG:2023年3月1日→20230301(西暦は下2桁まで)、23.03.01(数字のみ使用可)
<ロット番号>
OK:P20221201
NG:診20221201(半角英数記号以外を使用)、IVD01234567890123456789(長すぎ)
包装単位
包装単位とは、製品の荷姿の単位のことをいいます。
これまでは通知の中では「個装」「中箱」「外箱」の3つの包装単位が定義されており、各包装単位ごとにどの情報が必須表示であるか、任意表示であるかが決まっていました。
それらの定義の一部は、2022年9月13日付けの新通知発出によって改められます。
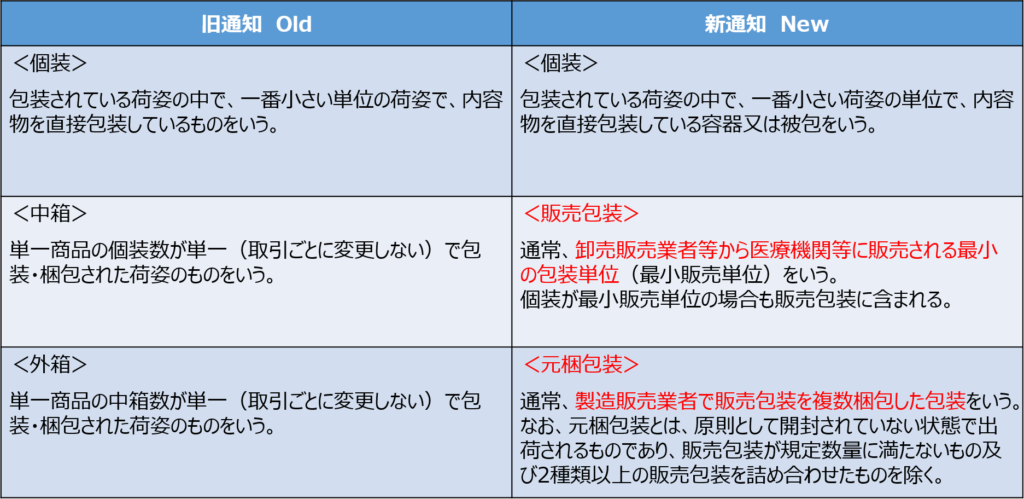
旧通知の「中箱」と「外箱」が、新通知では「販売包装」と「元梱包装」に変わってます。
「個装」の定義は変わっていませんね。
旧通知では、「個装」を一定数集めたものが「中箱」であり、「中箱」を一定数集めたものが「外箱」でした。
一方で新通知では、卸売販売業者から医療機関(ユーザー)に販売される荷姿を「販売包装」と呼び、製造販売業者が「販売包装」を複数梱包したものを「元梱包装」と呼ぶということが示されています。
これらの「個装」「販売包装」「元梱包装」ごとに、特定用符号を表示していくことになります。
施行日は2022年12月1日。経過措置は?
特定用符号の表示に関する改正の施行日は2022年(令和4年)12月1日です。
その根拠は、改正法附則第1条に記載されています。
(施行期日)
令和元年12月4日法律第63号 附則第1条(抜粋)
第1条 この法律は、公布の日から起算して1年を超えない範囲内において政令で定める日から施行する。ただし、次の各号に掲げる規定は、当該各号に定める日から施行する。
…
三 第3条…の規定 公布の日から起算して3年を超えない範囲内において政令で定める日
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
「第3条の規定」というのが、特定用符号の表示に関する改正規定です。「政令で定める日」から施行されることが分かりますね。
そして対応する政令では、施行日は(令和4年)2022年12月1日であると規定されています。
…改正法附則第1条…第三号に掲げる規定の施行期日は令和4年12月1日とする。
医薬品医療機器等法等を改正する法律の施行期日を定める政令(抜粋)令和2年3月11日政令第39号
原文は 厚生労働省 ホームページ にてご確認いただけます。

経過措置はあるのでしょうか?
経過措置については、改正法附則第7条にて定められています。
(医薬品等を識別するための符号の容器への表示等に関する経過措置)
令和元年12月4日法律第63号 附則第7条
第3条の規定の施行の際現に存する医薬品、医療機器又は再生医療等製品については、同条の規定による改正後の医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の2の5の規定は、適用しない。
原文は 総務省 e-Gov法令検索 にてご確認いただけます。

現に存するものについては適用しないとのことですので、既に出荷判定が済んだ医薬品等については特定用符号が表示されていなくても適法ですね。
また、改正法の適用時期については、厚生労働省の通知でも触れられています。
7.適用時期
令和4年9月13日 医政産情企発0913第2号 薬生安発0913第2号(抜粋)
1 医療機器(コンタクトレンズを除く)、体外診断用医薬品、医療機器以外の消耗材料
令和4年12月1日以降に製造販売業者(専ら医療機関で医療用に繰り返し使われる消耗材料は発売元)が出荷判定する製品より適用する。
…
原文は 厚生労働省ホームページ にてご確認いただけます。
施行日以降に出荷される製品に適用されるとありますが、施行日になってから慌てることがないよう、施行日前に表示を終わらせておくのがスマートでしょう。
現在は既に施行済みですので、まだ対応が済んでいない企業様は速やかに表示を開始してください。
施行日についてまとめると、
- 2022年12月1日以降に出荷判定する製品は特定用符号を表示する。
- 2022年12月1日時点で既に出荷判定済みの製品は特定用符号の表示は必須でない。
と、いうことですね。
特定用符号の表示の例外
上述のとおり、2022年12月1日以降に出荷される体外診断用医薬品については特定用符号の表示が必須となりますが、一部の体外診断用医薬品では表示の免除規定が存在します。
次の体外診断用医薬品では、表示不要の規定や表示に猶予期間を設ける規定が法令に明記されています。
- 一般用検査薬(一般用医薬品である体外診断用医薬品)
- 輸出用の体外診断用医薬品
- 緊急承認された体外診断用医薬品
- 特例承認された体外診断用医薬品
ひとつずつ確認してみましょう。
一般用検査薬は表示不要
一般用医薬品である体外診断用医薬品を「一般用検査薬」といいます。俗にOTC検査薬とも呼ばれます。
一般用検査薬では、特定用符号の表示は不要です。
…次に掲げる医薬品…については、第1項に規定する措置を講ずることを要しない。
一 第210条の3各号に掲げる医薬品
医薬品医療機器等法施行規則第228条の10の10第3項 令和4年9月13日厚生労働省令第128号による改正後(2022年12月1日施行)
二 …医療の用に供するガス
三 …
四 製造専用医薬品
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
第210条の3 法第52条第2項の厚生労働省令で定める医薬品は、次に掲げるものとする。
一 要指導医薬品
医薬品医療機器等法施行規則第210条の3 令和3年1月29日厚生労働省令第15号による改正後(2021年8月1日施行)
二 一般用医薬品
三 薬局製造販売医薬品
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
医療の用に供するガスや製造専用医薬品、要指導医薬品、一般用医薬品、薬局製造販売医薬品では、特定用符号の表示は不要とされています。
輸出用の体外診断用医薬品は表示不要
特定用符号の表示の目的は、国内での流通におけるトレーサビリティ向上のためとされています。
そのため海外で流通させることを目的とした「輸出用の体外診断用医薬品」については、特定用符号の表示義務はありません。
…体外診断用医薬品の輸出のための製造、輸入、販売、授与、貯蔵又は陳列については、法…第68条の2の5…の規定は、適用しない。…
医薬品医療機器等法施行令第74条の2第2項 令和3年1月5日政令第1号第2条による改正後(2022年12月1日施行)
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
「緊急承認」「特例承認」された体外診断用医薬品は特例措置
「緊急承認」や「特例承認」された体外診断用医薬品については、次の場合には特定用符号の表示義務が一時的に免除されます。
- 特定用符号の表示をすると流通の確保に支障がある場合
- やむを得ない理由がある場合

特定用符号の表示に時間がかかって…流通が遅れて…救える命が救えなかった…
なんてことにならないための一時的な免除規定ですね。
…法第23条の2の6の2第1項(法第23条の2の17第5項において準用する場合を含む。)若しくは第23条の2の8第1項(法第23条の2の20第1項において準用する場合を含む。)の規定による法第23条の2の5若しくは第23条の2の17の承認を受けて製造販売がされた…体外診断用医薬品…については、…体外診断用医薬品…を特定するための符号のこれらの容器又はこれらの被包への表示により流通の確保に支障を及ぼすおそれがある場合その他のやむを得ない理由がある場合は、前項の規定にかかわらず、同項に規定する措置を講ずることを要しない。
医薬品医療機器等法施行規則第228条の10の10第2項 令和4年9月13日厚生労働省令第128号による改正後(2022年12月1日施行)
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
法第23条の2の6の2というのが「緊急承認」の規定のことを指しています。法第23条の2の8は「特例承認」の規定を指しています。
なお、「緊急承認」や「特例承認」では、特定用符号の表示がずっと不要というわけではありませんので注意しましょう。あくまで一時的な規定であり、特定用符号の表示は準備が整い次第、実施していくこととなります。
通知中でもしっかりを釘を刺されていますね↓↓
なお、記載が可能になり次第速やかに対応すること。
「医療機器、体外診断用医薬品等を特定するための符号の容器への表示等について」令和4年9月13日付け医政産情企発0913第2号薬生安発0913第2号
原文は 厚生労働省ホームページ にてご確認いただけます。
特定用符号の表示の準備が整ったにもかかわらず漫然と不表示を貫くことはやめましょう。
特定用符号を表示しなかった場合の罰則
最後に、特定用符号の表示に関連する罰則についてまとめておきたいと思います。
具体的には次の2つの行為をすると罰せられます。
- 特定用符号が表示されていない体外診断用医薬品を販売、授与した場合。または販売、授与の目的で陳列、保管した場合。(第55条第1項)
- 特定用符号の表示のルールを守っているかどうか行政が立入検査等をしようとしたときに、拒み、妨げ、忌避した場合。(第69条第1項)
ひとつずつ確認してみましょう。
非表示品を販売、陳列、保管(懲役2年以下、罰金200万円以下)
特定用符号の表示のない体外診断用医薬品を販売、授与またはその目的で保管、陳列すると、医薬品医療機器等法第55条第1項の違反となり、罰せられます。
特定用符号の表示は製造販売業者の義務ではありますが、特定用符号の表示をしないだけで直ちに罪に問われることはありません。

取り締まる側からすると、非表示品(違反品)なのか、表示前の製品(製造途中)なのか、わかりませんからね。
メーカーからすると「製造途中だ!」と言い訳できてしまいます。
体外診断用医薬品の製造・出荷判定が無事終わり製品が在庫計上された時点(販売の目的で貯蔵)や、実際に出荷した時点(販売)で、特定用符号非表示品であると客観的に判断できるため、医薬品医療機器等法違反となります。

ち、違うんだ!これはまだ「製造途中」なんだ!

えっ、でも先輩、コレ在庫計上されて出荷できる状態になっちゃってますよ?
(販売の目的で貯蔵)

……..。
…第68条の2の5の規定に違反する医薬品は、販売し、授与し、又は販売若しくは授与の目的で貯蔵し、若しくは陳列してはならない。ただし、厚生労働省令で別段の定めをしたときは、この限りでない。
医薬品医療機器等法 第55条第1項(抜粋)2019年12月4日法律第63号による改正後(2022年12月1日施行)
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
また、この第55条第1項の条文をよく読むと「製造販売してはならない」ではなく「販売してはならない」という規定となっています。
ですので、特定用符号が表示されていない体外診断用医薬品を販売した者は、製造販売業者であろうと医薬品販売業者であろうと薬局であろうと、第55条第1項の規定に違反することとなります。
万が一、不表示品がユーザーのもとまで届いてしまった場合には製造販売業者だけでなく、不表示品を販売したとして卸売販売業者や店舗販売業者、薬局等も罪に問われる可能性があるということですね。
(店舗販売業者や薬局は新型コロナ特例により医療用の新型コロナ検査薬をユーザーに販売できますので一応記載していますが、一般用検査薬は表示対象外ですのであまり心配はないでしょう。また、主として一般用医薬品を販売する店舗販売業者や配置販売業者が罪に問われることはまずないでしょう。)
罰則については次の通りです。
次の各号のいずれかに該当する者は、2年以下の懲役若しくは200万円以下の罰金に処し、又はこれを併科する。
医薬品医療機器等法 第85条(抜粋)
…
三 第55条第1項(第60条、第62条、第64条、第65条の4及び第68条の19において準用する場合を含む。)の規定に違反した者
…
原文は 総務省 e-Gov法令検索 にてご確認いただけます。

2年以下の懲役もしくは200万円以下の罰金または両方、重いですね。
行政の立入検査等を拒否、妨害、忌避(罰金50万円以下)
行政(厚生労働大臣や都道府県知事のこと。)は、特定用符号の表示のルールを守っているかどうか確認するために、製造販売業者や製造業者に対して報告を求めたり、立入検査を実施することができます。<第69条第1項>
(厚生労働大臣や都道府県知事から委託を受けてPMDAが実施することもあります。)
厚生労働大臣又は都道府県知事は、医薬品…の製造販売業者若しくは製造業者…(以下この項において「製造販売業者等」という。)が、…第68条の2の5…の規定…を遵守しているかどうかを確かめるために必要があると認めるときは、当該製造販売業者等に対して、…必要な報告をさせ、又は…当該製造販売業者等が医薬品…を業務上取り扱う場所に立ち入り、その構造設備若しくは帳簿書類その他の物件を検査させ、若しくは従業員その他の関係者に質問させることができる。
医薬品医療機器等法 第69条第1項(抜粋)2019年12月4日法律第63号による改正後(2022年12月1日施行)
原文は 総務省 e-Gov法令検索 にてご確認いただけます。
行政から報告を求められたにも関わらず報告しなかったり、虚偽の報告をしたり、また、立入検査の実施を拒み、妨げ、忌避した場合には罰則を受けることになります。<第87条第1項>
罰則については次の通りです。
次の各号のいずれかに該当する者は、50万円以下の罰金に処する。
医薬品医療機器等法 第87条第13項(抜粋)
…
十三 第69条第1項…の規定による報告をせず、若しくは虚偽の報告をし、第69条第1項…の規定による立入検査…を拒み、妨げ、若しくは忌避し、又は第69条第1項…の規定による質問…に対して、正当な理由なしに答弁せず、若しくは虚偽の答弁をした者
原文は 総務省 e-Gov法令検索 にてご確認いただけます。

「忌避」とは「嫌って避けること」を言います。
検査を嫌がったり、検査対象の資料を隠したり、虚偽の資料を作成したり、
することが「忌避」に該当します。
適正なバーコード表示による法令遵守に努めたいと思います。
更新:特定用符号を割り当てるシステムの文書化
特定用符号の表示に関して、先日、厚生労働省から「特定用符号を割り当てるシステムを文書化することが望ましい」という旨の通知が発出されました。
通知:医療機器及び体外診断用医薬品を特定するための符号を割り当てるシステムの取扱いについて(令和4年11月10日 薬生監麻発1110第5号)
詳細は特定用符号を割り当てるシステムの文書化のページにまとめましたのでぜひご確認ください。

コメント