こんにちは、ジンです。
体外診断用医薬品の電子添文(電子化された添付文書)は、その体外診断用医薬品に関する最新の知見に基づいて記載されていなければなりません。
記載されている情報が古くなった際には電子添文を改訂しますが、改訂時には改訂箇所が分かるようにする必要があります。
改訂箇所の示し方については、次の2つの通知で定められています。
- 【局長通知】体外診断用医薬品の電子化された添付文書の記載要領について(薬生発0611第5号)
- 【課長通知】体外診断用医薬品の添付文書の記載要領について(薬食安発第0310014号)
しかしながら、局長通知と課長通知で改訂箇所の示し方が統一されていないため、各診断薬メーカーで改訂箇所の表記の仕方が異なっているという事態が発生しています。
そこで、厚生労働省、PMDA、日本臨床検査薬協会の3者で、体外診断用医薬品の電子添文の改訂箇所の示し方について話し合いがおこなわれ、Q&Aが合意されました。
2021年9月10日付け臨薬協発2021-035号
「体外診断用医薬品の電子化された添付文書の改訂箇所の示し方について」
本ページでは3者で合意されたQ&Aを元に、体外診断用医薬品の電子添文の改訂箇所の示し方をご紹介したいと思います。
※Q&Aは厚生労働省、PMDA、日本臨床検査薬協会の3者で合意されたものではありますが、あくまで記載要領が改訂されるまでの暫定的な運用ルールのようです。
※その後、2022年7月21日に記載要綱が改訂されましたが、改訂箇所の示し方については反映されませんでした。
局長通知、課長通知では…
電子添文の改訂箇所の示し方については、もともと厚生労働省からの通知によって規定されています。
- 「体外診断用医薬品の電子化された添付文書の記載要領について」
(令和3年6月11日付け薬生発0611第5号局長通知、最終改正:令和4年7月21日) - 「体外診断用医薬品の添付文書の記載要領について」
(平成17年3月31日付け薬食安発第0331014号課長通知、最終改正:令和4年7月21日)
それぞれの通知では次の図1のように、規定されています。
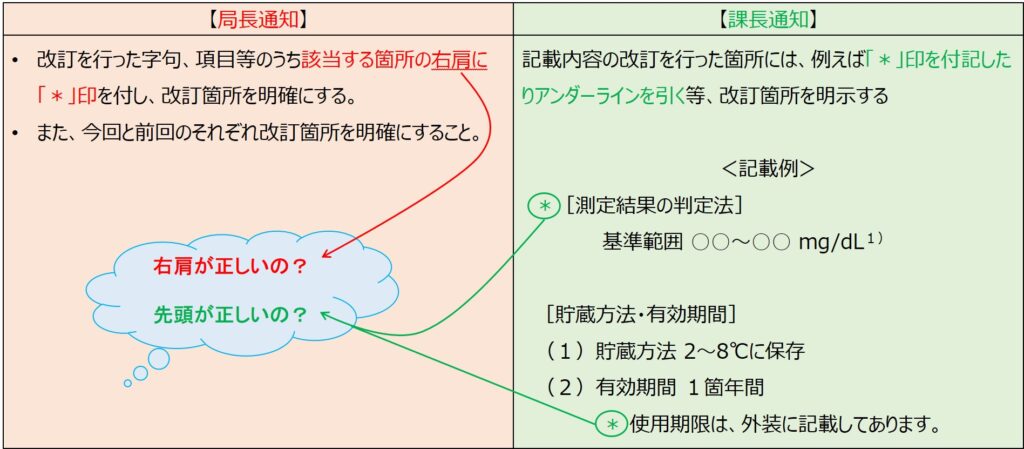
局長通知では「該当箇所の右肩に*印」と言われていますが、課長通知の記載例では該当箇所の先頭に*印が付いています。

いや、どっちやねん

局長(上司)と課長(部下)では局長の方が権限が強いので
局長通知に従うべきでしょうか?
改訂箇所の示し方についての考え方が、局長通知と課長通知で統一されていないため、各診断薬メーカーで改訂箇所の表記の仕方が異なってしまうという事態が生じていました。
また、課長通知では、【例えば「*印」】というように例示として規定されていたためか、「*」印を使用せずに「※」や「†」、「‡」等の記号を使用しているものも一部見受けられました。

各記号はそれぞれ、
*(アスタリスク)
※(米印)
†(ダガー)
‡(ダブルダガー)
と読みます。
各診断薬メーカーで改訂箇所の示し方を統一した方が、ユーザー側からすると改訂箇所を適切にスムーズに知ることができていいですね。
記載方法の統一
それでは、ようやく本題です。
改訂箇所の示し方を統一していた方がユーザーにとって分かりやすいよね~
ということで、厚生労働省とPMDA、日本臨床検査薬協会の3者が協議し、
「体外診断用医薬品の電子化された添付文書の改訂箇所の示し方に関するQ&A」が合意されました。
Q&Aで示されているのは、次の6点です。
- 【前提1】改訂記号はアスタリスク「*」を使う
- 【前提2】第2版では「*」、第3版以降では「**」も使う
- 【前提3】直近2回の改訂箇所が同じ場合は「*」と「**」を同時に使う
- 【ルール】「*」は最も下位の項目の前に付ける
- 【例外1】項目ごと新設する場合は、上位の項目に「*」を付ける
- 【例外2】項目ごと削除する場合は、「*」を付けない
- 【例外3】内容に影響を与えない修正のときは「*」を付けなくてもよい
詳しく見ていきましょう。
【前提1】改訂記号はアスタリスク「*」を使う
改訂記号には上述しただけで4種類のものがありました。
*(アスタリスク)
※(米印)
†(ダガー)
‡(ダブルダガー)
これらのうち、電子添文の改訂時に使用できるものは「*」のみに統一され、
他の改訂記号(※、†、‡)等は、使用しないこととされました。

【前提2】第2版では「*」、第3版以降では「**」も使う
第2版改訂の際には、改訂個所に「*」を付けて改訂個所を示します。
では、第3版以降の改訂時にはどうすればよいのでしょうか?第3版以降の改訂時には、前回改訂箇所と今回改訂箇所が明確にわかるように記載しなければなりません。
第3版以降の改訂時には、
- 「*」アスタリスク1個で、前回改訂箇所を示し、
- 「**」アスタリスク2個で、今回改訂箇所を示す。
というようなルールが、Q&Aで示されています。
つまり、
- 第2版改訂では「*」のみを使用する。
- 第3版以降の改訂では、前回改訂箇所を「*」、今回改訂箇所を「**」とする。
と、いうことですね。まずは、第2版改訂の記載例を見てみましょう(下図3)。

第2版改訂では、赤色で示したように「*」のみを使用します。
(実際の改訂時には赤字ではなく黒字で記載します。)
続いて、第3版以降の改訂について記載例を見てみましょう(下図4)。

第3版以降の改訂では、前回改訂箇所は赤色で示したように「*」アスタリスク1個、今回改訂箇所は青色で示したように「**」アスタリスク2個を使います。
【前提3】直近2回の改訂箇所が同じ場合は「*」と「**」を同時に使う
なお、直近2回の改訂が同じ箇所になった場合には、同じ箇所に「**」と「*」を両方記載します。
下図5の例をご覧ください。
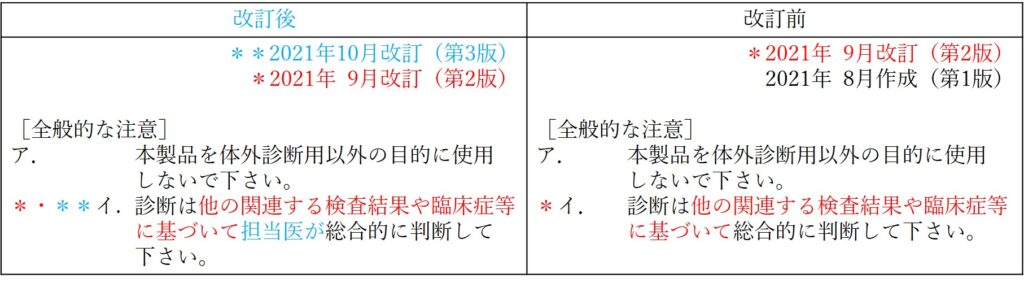
「**」と「*」を両方記載する場合の表示の仕方については、「**」と「*」の順番などの詳細は規定されていませんでした。
- 「** *」
- 「**・*」
- 「**、*」
- 「* **」
- 「*・**」
- 「*、**」
PMDAホームページに電子添文を掲載するときにはSGMファイルが必要です。PMDAが配布している「体外診断薬SGML作成ツール」を使用してSGMファイルを作成すると、「**」と「*」を両方記載する場合には、
「** *」と表示されます。
(アスタリスク2個とスペース1個とアスタリスク1個)
ですのでPDFファイルの電子添文でも「** *」と表示しておいた方が無難でしょう。
【ルール】「*」は最も下位の項目の前に付ける
また、改訂記号を付ける位置についても統一があります。
改訂箇所に該当する最も下位の項目の前に改訂記号を付けなければなりません。
どういうことでしょうか?下図6で確認してみましょう。

図6では、「ハ.」の文章の一部が改訂されています。この時の「*」の正しい位置は「ハ.」の前です。
上位の項目「使用上又は取り扱い上の注意」の前ではなく、
上位の項目「(1)取り扱い上(危険防止)の注意」の前でもなく、
最も下位の項目「ハ.」の前に「*」を付けます。
図6中の、青色の「*」の位置は誤りで、赤色の「*」の位置が正しいということです。
【例外1】項目ごと新設した場合は、上位の項目に「*」を付ける
体外診断用医薬品では、厚生労働省の通知等で注意事項が指定されることがあります。例えば過去には、厚生労働省から次のような事務連絡が発出されました。
警告の項に「実際の血糖値より高い値を示すため、以下の患者には使用しないこと。」と記載すること。
平成16年9月29日 事務連絡「グルコース脱水素酵素(GDH)法を用いた血糖測定器に係る自主点検等について」
1)マルトースを含む輸液等を投与中の患者
2)イコデキストリンを含む透析液を投与中の患者
3)ガラクトース負荷試験を実施中の患者
4)キシロース吸収試験を実施中の患者
そういう時には電子添文の「警告」や「重要な基本的注意」の欄などに追記しなくてはなりません。
これまで存在しなかった項目を新設する場合には、新設する箇所の上位の項目に「*」を付けます。

図7の例でいうと、[警告]の前に「*」を付けます。(青い「*」は不要です。)
【例外2】項目ごと削除する場合は、「*」を付けない
製品の改良や販売後情報の収集によって、これまで記載されていた項目が不要になることがあります。項目ごと削除する場合には、「*」は付ける必要はありません。

何もないところに、ぽつんと「*」があったらちょっと変ですね。
【例外3】内容に影響を与えない修正のときは「*」を付けなくてもよい
電子添文を改訂する場合には改訂箇所を「*」で示しますが、Q&Aによると次の修正については改訂箇所を明示する必要はないということです。
- 句読点や「てにをは」の修正
- 改行等体裁を整える修正
元々、局長通知や課長通知では、軽微な修正についての例外規定はありませんので、どんなに軽い修正であっても改訂記号「*」を付ける必要がありました。
必要以上に「*」を付けることで、使用者にとって読みづらくなったり、重要な改訂が隠れてしまうかもしれませんので、「てにをは」など内容に影響を与えない修正については、改訂箇所を明示する必要はなくなりました。
おわりに
臨床検査薬協会から発出された通知の原本は、臨床検査薬協会の会員ページにログインすることでご確認いただけます。(協会会員以外の方は閲覧できません。)
2021年9月10日付け臨薬協発2021-035号
「体外診断用医薬品の電子化された添付文書の改訂箇所の示し方について」
本件は日本臨床検査薬協会会員にのみ周知されており、加入していない企業の方は閲覧できません。
行政からの事務連絡の発出や記載要領通知の改正等が無ければ、完全な全社統一は実現できないような気はしていますが、とはいえ、業界ルールとして改訂箇所の示し方についての一定の見解が示されましたので、あとは同じ方向に向かって進んでいくだけです。
ユーザー様がより読みやすい電子添文になることを願っています。

コメント