2022年5月20日に医薬品医療機器等法を改正する法律が公布されました。
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律
(令和4年5月20日法律第47号)
本改正では、医薬品等の緊急承認制度の創設や処方箋の電子化等が盛り込まれています。
このうち緊急承認制度の創設については、体外診断用医薬品に関しても関係があるようですので情報収集がてらまとめてみました。

2022年11月22日付けで塩野義製薬の医薬品が初の緊急承認を受けましたが、
体外診断用医薬品では「緊急承認」されたものは、まだありませんね。
<2022年3月1日 国会提出>
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律案
(第208回閣法第42号)
<2022年4月19日 衆議院可決>
全会一致
<2022年5月13日 参議院可決>
全会一致
<2022年5月20日 法律公布>
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律
(令和4年法律第47号)
※本ページでは体外診断用医薬品について特化してご紹介しています。医薬品や医療機器、再生医療等製品についても「準じた改正を行う」と厚生労働省の通知中で説明されていますので大筋は変わりませんが、細かい違いがあるかもしれませんのでご了承ください。
現行の承認制度
さっそく本題に入りたいところですが、本題の「緊急承認制度」の前にまずは現行の承認制度のおさらいをしておきましょう。
ここ2、3年はコロナ禍という、一種の国の一大事ということもあり、「通常承認」だけでなく、「条件付き承認」や「特例承認」等いろいろな言葉を耳にするようになりました。

体外診断用医薬品で「条件付き承認」や「特例承認」されたという話は、耳にしませんが…
体外診断用医薬品の承認については、医薬品医療機器等法の第23条の2の5に規定されています。
…体外診断用医薬品…の製造販売をしようとする者は、品目ごとにその製造販売についての厚生労働大臣の承認を受けなければならない。
医薬品医療機器等法第23条の2の5(抜粋)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
つまり、体外診断用医薬品を製造販売するためには承認を受けてください、ということですね。
※「製造販売」の意味については、”「製造販売」とは?「製造」や「販売」との違い”のページでご紹介しています。
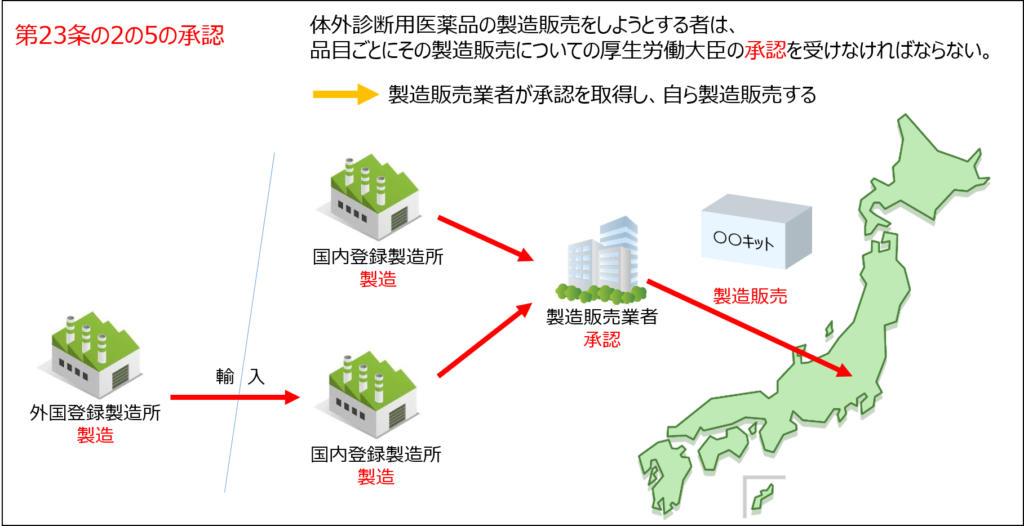
認証・届出対象品目以外の全ての体外診断用医薬品は、製造販売をするために、第23条の2の5の承認を取得することがマストとなっています。
一方で第23条の2の5の承認にはいくつかのオプションがあります。
上で出てきた「条件付き承認」や「特例承認」、そして今回の改正で加わった「緊急承認」が、オプションにあたります。

※今回の改正で創設された「緊急承認制度」については、まったく新しい承認様式であるとするのは厳密には誤りで、第23条の2の5の承認について新しい承認オプションが加わったとする方が正しい理解であると思います。
各承認オプションを利用することで、申請資料の一部を省略できたり(承認後に要提出)、他の体外診断用医薬品の審査よりも優先的に審査してもらえたりで、結果的に申請から承認までにかかる時間が大幅に短縮されます。
各オプションを利用するにはそれぞれ条件があります。
各承認オプションの利用条件に該当しない場合には、「通常承認」となります。
通常承認と各承認オプションの特徴を簡単にまとめてみました。
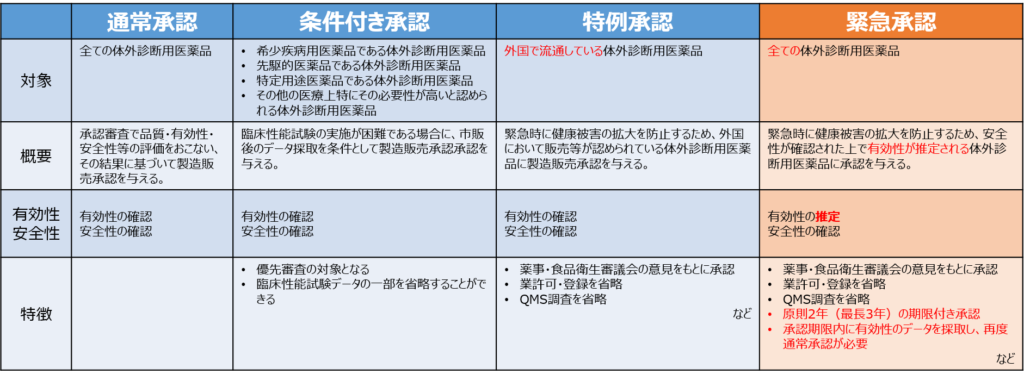
それぞれのオプションについて簡単に確認していきましょう。
「条件付き承認」とは?
まずは、「条件付き承認」です。
通常、体外診断用医薬品の承認申請をする際には、臨床性能試験を実施し、その試験成績に関する資料を申請書に添付しなければなりません。
臨床性能試験の実施は体外診断用医薬品の臨床上的意義を確立する方法として有用なものではありますが、その一方で、被験者集め等で多くの時間がかかるという欠点もあります。
そこで、患者数が少ないなどの理由で臨床性能試験の実施が困難であるときや試験の実施に時間がかかる場合には、製造販売後にデータを採取・報告するという条件を付けることで、臨床性能試験成績に関する資料の一部を添付しなくても承認できるという規定が創設されました(2019年薬機法改正、2020年9月施行)。
これを「条件付き承認」といいます。
臨床性能試験の実施が困難であれば、何でもかんでも「条件付き承認」できるかというとそういうわけではありません。
「条件付き承認」の対象となる体外診断用医薬品は法令や通知等で明確にされています。
法律上定めのある次の体外診断用医薬品は「条件付き承認」の対象となることができます。
- 希少疾病用医薬品に指定された体外診断用医薬品
- 先駆的医薬品に指定された体外診断用医薬品
- 特定用途医薬品に指定された体外診断用医薬品
- ニーズ検討会で医療上特にその必要性が高いと認められるものとして選定された体外診断用医薬品
また、上の4つのいずれにも該当しない場合であっても、いくつかの要件を満たす体外診断用医薬品については、PMDAの開発前相談を受けることで「条件付き承認」の対象と判断される場合があります。
いずれの場合でも無事「条件付き承認」の対象であるとされた暁には、
- 承認申請時の臨床性能試験成績に関する資料の一部が免除されたり(承認後にデータをそろえて提出)
- 他の体外診断用医薬品よりも優先的に審査してもらえることで(優先審査)
承認までの期間が大幅に短縮されます。
「特例承認」とは?
続いては、「特例承認」です。
「特例承認」は、「条件付き承認」と比べて、より重大なときや緊急性が高いときに選択されます。
「特例承認」とは、重大な健康被害の拡大を防ぐために、外国で既に承認・販売されている体外診断用医薬品を、通常よりもかなり簡略化された手続きで国内承認することをいいます(2013年薬機法改正、2014年11月施行)。
次の3つの要件を全て満たす体外診断用医薬品が「特例承認」を受けることができます。
- 命にかかわる疾病のまん延や健康被害の拡大を防止するために緊急に使用される必要があること
- その体外診断用医薬品以外に適当な方法がないこと
- 日本と同じ水準の承認制度がある国で、承認され販売されていること
条件の3つ目にあるように、外国で既に販売実績のある体外診断用医薬品のみが対象となるため、日本で開発された新体外診断用医薬品は対象にはなりません。
なお、「日本と同じ水準の承認制度がある国」とは、次の5か国のことをいいます。
- アメリカ合衆国
- 英国(イギリス)
- カナダ
- ドイツ
- フランス
※上記は医薬品における「日本と同じ水準の承認制度がある国」を挙げています。体外診断用医薬品における「日本と同じ水準の承認制度がある国」は現在のところ法令で定義されていませんが、今後定義されるのであればMDSAP加盟国のブラジルとオーストラリアを含めて7か国となるのでは?と筆者は予想しています。
上の「条件付き承認」では、承認申請資料の一部が省略できるという特徴がありましたが、「特例承認」では、
- 申請者の製造販売業許可や製造所の製造業登録を不要としたり
- QMS適合性調査の実施やQMS省令への適合を不要としたり
等、いくつかの承認要件を非適用とすることで、承認までにかかる時間を最大限に短縮するための措置が取られます。
そのため「特例承認」では、承認までの期間が極めて短くなります。
また「特例承認」では、通常承認のような承認審査の結果のみに基づいた承認は行われません。
承認審査の結果をもとに薬事審議会でさらに審議され、審議会での審議結果を基に「特例承認」がおこなわれます。
<特例承認の際に非適用とされる規定>
- 申請者が製造販売業許可を受けていること(第23条の2の5第2項第1号)
- 製造所が製造業登録を受けていること(第23条の2の5第2項第2号)
- 承認審査の結果、申請した性能を有すると認められること(第23条の2の5第2項第3号イ)
- 承認審査の結果、性状又は品質が保健衛生上不適当でないこと(第23条の2の5第2項第3号ハ)
- QMS省令に適合していること(第23条の2の5第2項第4号)
- 承認審査では申請資料に基づき、品質・有効性・安全性の調査をおこなう(第23条の2の5第6項)
- 承認申請時及び承認申請後5年毎にQMS適合性調査を受けること(第23条の2の5第7項)
- QMS適合性調査が免除可能な場合でも厚生労働大臣が必要と認めたときには受けること(第23条の2の5第9項)
- 新体外診断用医薬品の承認時には薬事審議会の意見を聴くこと(第23条の2の5第11項)
QMS適合性調査の免除についての規定がありますが、一方で、厚生労働大臣が体外診断用医薬品の特性を勘案して必要があると認める場合には、QMS適合性調査を受けなくてはなりません。
QMS適合性調査が必要とされた場合の申請方法や手数料、調査要綱は、一般的な体外診断用医薬品のQMS適合性調査と同様となります。
- 「基準適合証及びQMS適合性調査申請等の取扱いについて」(令和2年8月31日薬生監麻発0831第1号 薬生機審発0831第16号)
- 手数料令第33条第5項に定める各区分の手数料
- 「QMS調査要領について」(令和3年3月26日薬生監麻発0326第12号)
「緊急承認」とは?
現行の承認オプションのおさらいができたところで、いよいよ「緊急承認」オプションです。
「緊急承認」とは、重大な健康被害の拡大を防ぐために緊急に使用されることが必要な体外診断用医薬品を、通常よりもかなり簡略化された手続きで国内承認することをいいます。
「特例承認」と似ていますので、比較するとわかりやすいと思います。
「緊急承認」は「特例承認」よりもさらに重大なときや緊急性が高いときに選択されます。
次の3つの要件を全て満たす体外診断用医薬品が「緊急承認」を受けることができます。
- 命にかかわる疾病のまん延や健康被害の拡大を防止するために緊急に使用される必要があること
- その体外診断用医薬品以外に適当な方法がないこと
- 申請に係る有効性を有すると推定されるものであること
3番目の要件が、「特例承認」とは違う点ですね。
「特例承認」では、3番目の要件として海外での販売実績が規定されていましたが、「緊急承認」ではその要件は削除されています。
そのため、海外で販売実績があるものは当然のことながら、日本で独自に開発した新体外診断用医薬品も「緊急承認」の対象となることができます。
一方で「緊急承認」では3番目の要件として、有効性を有すると推定されるものであること、が追加されています。
通常、体外診断用医薬品の承認では、安全性の確認と有効性の確認が必須となっていますが、「緊急承認」では安全性の確認は必須としつつも、有効性については推定レベルでの承認が可能となっています。
有効性の推定レベルで承認できてしまうということは、他の承認オプションでは見られない大きな特徴です。

「○○ウイルス感染症の診断に有用であると推定されるキット」が承認できるようになるということですね。
また、「緊急承認」では「特例承認」と同様に、申請者の製造販売業許可や製造所の製造業登録を不要としたり、QMS適合性調査の実施やQMS省令への適合を不要としたりと、いくつかの承認要件を非適用とすることで承認までにかかる時間を最大限に短縮するための措置が取られます。
そのため「緊急承認」では、承認までの期間が極めて短くなります。
「緊急承認」においても、薬事審議会での検討の結果を基に承認がおこなわれる点は「特例承認」と同様ですね。
<緊急承認の際に非適用とされる規定>
- 申請者が製造販売業許可を受けていること(第23条の2の5第2項第1号)
- 製造所が製造業登録を受けていること(第23条の2の5第2項第2号)
- 承認審査の結果、申請した性能を有すると認められること(第23条の2の5第2項第3号イ)
- QMS省令に適合していること(第23条の2の5第2項第4号)
- 承認審査では申請資料に基づき、品質・有効性・安全性の調査をおこなう(第23条の2の5第6項)
- 承認申請時及び承認申請後5年毎にQMS適合性調査を受けること(第23条の2の5第7項)
- QMS適合性調査が免除可能な場合でも厚生労働大臣が必要と認めたときには受けること(第23条の2の5第9項)
- 新体外診断用医薬品の承認時には薬事審議会の意見を聴くこと(第23条の2の5第11項)
「特例承認」と同様にQMS適合性調査の免除についての規定がありますが、
厚生労働大臣が体外診断用医薬品の特性を勘案して必要があると認める場合には、QMS適合性調査を受けなくてはなりません。
QMS適合性調査が必要とされた場合の申請方法や手数料、調査要綱は、一般的な体外診断用医薬品のQMS適合性調査と同様となります。
- 「基準適合証及びQMS適合性調査申請等の取扱いについて」(令和2年8月31日薬生監麻発0831第1号 薬生機審発0831第16号)
- 手数料令第33条第5項に定める各区分の手数料
- 「QMS調査要領について」(令和3年3月26日薬生監麻発0326第12号)
「特例承認」と異なる点として、「緊急承認」では次の規定が非適用とならないことが挙げられます。
- 承認審査の結果、性状又は品質が保健衛生上不適当でないこと(第23条の2の5第2項第3号ハ)
「特例承認」は海外での販売実績を必要としますので、製品の性状や品質がある程度既知であり、保健衛生上不適当でないことが予測されますが、
一方で「緊急承認」では新規の体外診断用医薬品も制度の対象になりますので、「保健衛生上不適当でないこと」という規定は通常通り適用されることとなっています。

ある感染症を99.9%正確に診断できる体外診断用医薬品であっても、例えば検査する時に検査者の99.9%が感染症に罹患してしまうような製品であれば、当然に緊急承認されませんよね。
(保健衛生上不適当)
なお、「緊急承認」は有効性が推定レベルでの承認ですので、原則2年(最長3年)という期限付きの承認となっています。
この承認の期限が切れる前に、臨床性能試験による有効性の確認を実施し再度承認を受けなくてはなりません。
「特例承認」では承認の期限はありませんし、再度承認を受けなおす必要もありませんので、「承認の期限があること」と「期限内に再承認が必要であること」は、「緊急承認」の大きな特徴といえるでしょう。
<緊急承認まとめ>
- (特例承認と異なり)海外で販売実績がなくても承認可能
- 安全性は従来と同程度の確認が必要、有効性は推定レベルでOK(フェーズⅢが不要)
- (特例承認と同様に)承認までにかかる時間を最大限に短縮するための措置が取られる
- 原則2年(最長3年)の期限付きの承認
- 承認の期限内に有効性データを取得し再承認が必要
「緊急承認」は2022年5月20日施行
2022年5月20日付けで改正法が公布され、即日施行されました。
緊急承認についての規定は、2022年5月20日から適用されてます。
本ページでは、2022年5月に新しく施行された「緊急承認」制度についてご紹介しました。
「緊急承認」とは、国民の生命や健康に重大な影響を与えるおそれがある健康被害の拡大を防止するため緊急に使用されることが必要な体外診断用医薬品について、その体外診断用医薬品以外に適当な方法がない場合に、安全性の確認を前提に、有効性が推定されたときに迅速に薬事承認することをいいます。
「緊急承認」では、いくつかの承認要件を非適用とすることで承認までにかかる時間を最大限に短縮するための措置が取られます。
その代わり、「緊急承認」は、原則2年(最長3年)という期限付きの承認となっており、期限が切れる前に有効性のデータを集めて再承認を受けなくてはならないという特徴もあります。
詳細な情報が出てきましたら、随時更新していきたいと思います。
緊急承認に関連する条文の逐条解説
今回の改正で新設された条文の逐条解説を作成してみましたので、ご参考にしていただければと思います(随時更新)。
<参考にしたもの>
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(令和4年5月20日法律第47号)
- 「緊急承認及び特例承認に係る適合性調査の取扱いについて」(令和4年5月20日薬生監麻発0520第1号)


コメント